Laboratorios clínicos – Requisitos de calidad y competencia
Importancia de la norma ISO 15189 y cambios en la nueva versión 2022
La norma ISO 15189 es un estándar internacional desarrollado por la Organización Internacional de Normalización (ISO) que establece requisitos para la competencia técnica y la calidad de los laboratorios clínicos y que contribuye a asegurar la confiabilidad de los resultados de los análisis.
Se han publicado a la fecha cuatro versiones de la norma ISO 15189. La última versión fue publicada el 6 de diciembre de 2022 y contiene cambios estructurales y de contenido sustanciales con respecto a las versiones anteriores, alineando sus requisitos a los de la Norma ISO/IEC 17025:2017 que describe requisitos sobre calidad y competencia de laboratorios de ensayo y calibración.
Esta 4ta. edición tiene como objetivo primordial promover la seguridad del paciente y la gestión de riesgos y oportunidades de mejora. Los beneficios de este enfoque incluyen: aumento de la eficacia del sistema de gestión, disminución de la probabilidad de generar resultados no válidos y reducir el daño potencial causado a los pacientes, al personal del laboratorio, a la sociedad y al medio ambiente. Esta norma está destinada a utilizarse en: laboratorios clínicos y a otros servicios del cuidado de la salud, como diagnóstico por imágenes, terapia respiratoria, pruebas fisiológicas, bancos de sangre y servicios de transfusión.
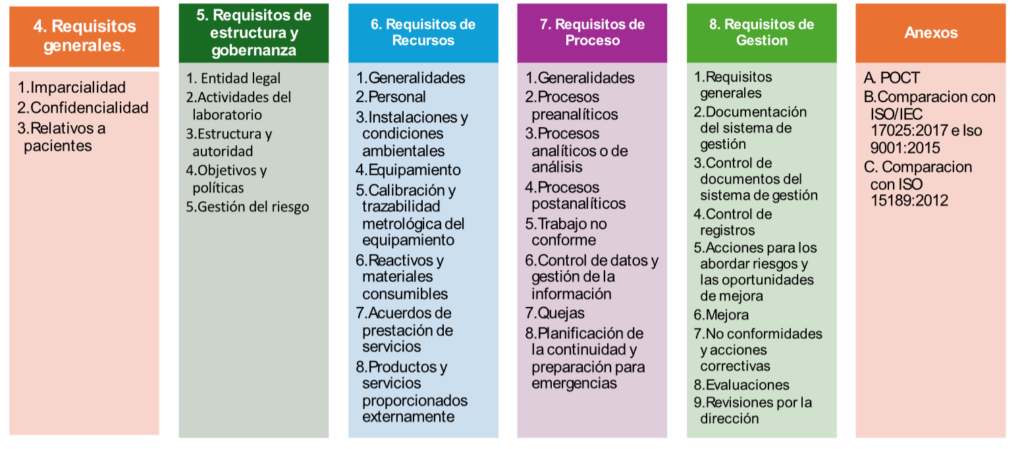
Los requisitos se agrupan en cinco grandes capítulos :
- Requisitos Generales
- Requisitos de Estructura y Gobernanza
- Requisitos de los Recursos
- Requisitos de los Procesos
- Requisitos del Sistema de Gestión
Requisitos del Sistema de Gestión
Los anexos contienen:
Anexo A ( normativo obligatorio): Requisitos adicionales para los análisis realizados cerca
del paciente (POCT)
Anexo B: Comparación con las Normas ISO 9001:2015 e ISO/IEC 17025:2017
Anexo C: Comparación con las Normas ISO 15189:2012
Requisitos de la norma ISO 15189:2022
Requisitos de la norma ISO 15189:2022
Entre los cambios importantes se puede destacar que :
● Se mencionan otros estándares ISO para laboratorios clínicos que son útiles como apoyo para la implementación de estos requisitos: ISO 22367 (Gestión de riesgo), ISO 15190 (Seguridad); ISO 20658 (Toma y transporte de muestras), ISO 17511 (trazabilidad de calibradores, controles y muestras humanas); ISO/TS 20914 (Incertidumbre de medición); ISO 15194 (requisitos para materiales de referencia); 15193 (requisitos para procedimientos de referencia), ISO 17034 (requisitos para productores de materiales de referencia) ; ISO/IEC 17043 (requisitos para proveedores de programas de ensayos de aptitud), ISO 35001 (Riesgo biológico)
● Se incluye un anexo para aplicarla a los ensayos junto al paciente POCT, que reemplaza a la Norma ISO 22870 la cual queda fuera de vigencia.
● Se amplían los requisitos de trazabilidad metrológica para asegurar la exactitud de las mediciones.
● Se eliminan los requisitos de acciones preventivas en el capítulo 8 y se reemplazan por la gestión de riesgo y oportunidades de mejora.
● Se incluyen requisitos nuevos para abordar situaciones de emergencia y desastres.
● Se incluyen requisitos relativos a los pacientes.
El cumplimiento de los requisitos permite que un laboratorio solicite la acreditación por un organismo de acreditación que opere con la norma ISO/IEC 17011 (requisitos para organismos de acreditación).
Los requisitos de gestión se consideran alcanzados si el laboratorio cumple con los correspondientes en las normas ISO 9001 ó ISO/IEC 17025 o con los descritos en el capítulo de Sistema de Gestión (capítulo 8), de la nueva versión.
Etapas en el estudio de la Norma ISO 15189 y cronograma de su revisión
Esta Norma se estudia en el Grupo de Trabajo 1 (WG1) del Comité Técnico TC 212 de ISO . Los miembros que participan como miembro P ( participante) pueden votar y hacer comentarios a las normas en estudio o revisión y pueden participar en las reuniones internacionales de ISO. El organismo de normalización de Argentina es el “Instituto Argentino de Normalización y Certificación” (IRAM), el cual es miembro P (participante) de ISO, por lo cual tiene el derecho a votar normas y a participar en las reuniones internacionales.
El estudio de una norma ISO consta de varias instancias y de ellas se desprenden diferentes documentos :
- Borrador de trabajo (WD, Working Draft).
- Borrador de comité (CD, Comittee Draft).
- Borrador de norma internacional (Draft international Standard, DIS).
- Borrador final de norma internacional (Final Draft international Standard, FDIS).
- Norma publicada.
Los documentos borradores que se generan durante el estudio inicial o la revisión de una norma se envían a los respectivos miembros P de ISO en cada país para su votación , la cual puede ser : voto positivo con o sin comentarios, voto negativo o abstención.
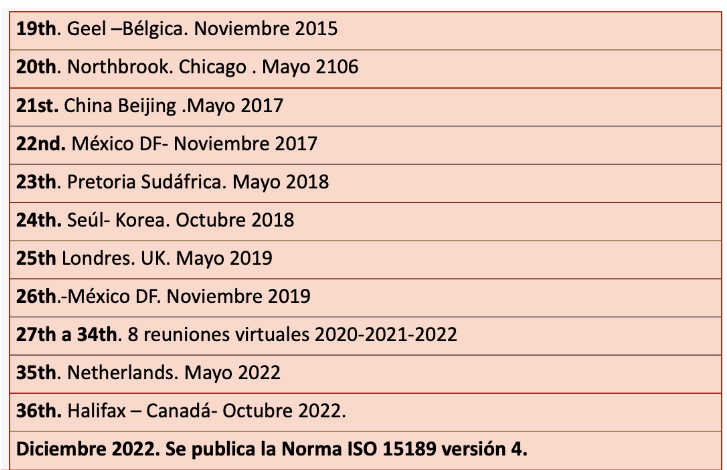
La norma se registra como proyecto en 2018 en el 24th. Meeting del WG1 llevado a cabo en Seul-Korea , pero ya desde 2015 se comienza a discutir su revisión en las reuniones del WG1 El plan para su revisión estimó una duración de 48 meses con fecha probable de publicación a mediados de 2022 . Dado que La norma ISO 15189 deriva de la norma ISO/IEC 17025, que se estudia en el Comité ISO/ CASCO , representantes del mismo custodiaron durante la revisión que se respetara la alineación con esta última .
La Dra. Silvia Depardo , experta designada por el IRAM junto a la Dra. Analía Purita, coordinadora del subcomité de análisis clínicos de este organismo participaron como delegadas por Argentina en el estudio de esta cuarta versión de la norma ISO 15189 durante las reuniones del WG1 y las reuniones plenarias anuales del ISO/TC 212. Asimismo participaron en otros grupos de trabajo para de revisión de normas de apoyo como la ISO 20658, ISO 35001 e ISO 22367. Las reuniones se llevaron a cabo en diferentes países en modo presencial y, durante la pandemia, en forma virtual.
Etapas en el estudio de la Norma ISO 15189 y cronograma de su revisión
La Dra. Silvia Depardo , experta designada por el IRAM junto a la Dra. Analía Purita, coordinadora del subcomité de análisis clínicos de este organismo participaron como delegadas por Argentina en el estudio de esta cuarta versión de la norma ISO 15189 durante las reuniones del WG1 y las reuniones plenarias anuales del ISO/TC 212. Asimismo participaron en otros grupos de trabajo para de revisión de normas de apoyo como la ISO 20658, ISO 35001 e ISO 22367. Las reuniones se llevaron a cabo en diferentes países en modo presencial y, durante la pandemia, en forma virtual.

Reuniones para la revisión de la Norma ISO 15189:2022
Para la revisión de la norma los delegados se dividieron en grupos de trabajo para cada requisito quedando 3 grupos finales con los Team Leaders que iban a coordinar la revisión durante su estudio. El primer borrador (CD1) que salió a votación recibió unas 470 páginas de comentarios de los países miembros P de ISO. Del análisis de estos comentarios surgió un nuevo borrador (CD 2) que volvió a enviarse a votación y así sucesivamente con todos los borradores. El DIS y el FDIS fueron publicados en 2022 y finalmente el 16 de diciembre de 2022 se publicó la 4ta versión de la Norma a ISO 15189. Por otro lado, en la reunión plenaria de México en 2019 se conformó el comité ISO/TC212/STTF (Spanish Translation Task Force), integrado actualmente por catorce países hispanoparlantes, para la traducción oficial de normas del ISO/TC212 al español, designando a la Dra. Analía Purita de IRAM como coordinadora de este comité. Este grupo trabajó en la traducción tomando como base el borrador FDIS y la norma oficial en español fue publicada en enero de 2023
Transición de la versión 2012 a la versión 2022
La resolución GA 26.08 de la Cooperación Internacional de Acreditación de Laboratorios (ILAC) acordó que:
a) Eel período de transición desde la versión 2012 a la versión 2022 de la norma ISO 15189 será de tres años.
b) Tteniendo en cuenta que los requisitos para los análisis en el punto de atención del paciente (POCT) contenidos en la norma ISO 22870:2016 se han incorporado a la norma ISO 15189 actualizada, la norma ISO 22870:2016 junto con la norma ISO 15189:2012 aún se reconocerá como una norma de nivel 4 para POCT durante el período de transición.
c) AAl final del período de transición, la acreditación de un laboratorio clínico con la ISO 15189:2012 y la acreditación de POCT con la ISO 22870:2016 junto con la ISO15189:2012 no serán reconocidas bajo el Acuerdo de ILAC.
d) Para el 6 de diciembre de 2025 todos los laboratorios acreditados por un organismo de acreditación que deseen reacreditar , deberán haber sido evaluados con la versión 2022,
La norma ISO 15189:2022 representa un avance importante para los laboratorios clínicos ya que, a diferencia de las versiones anteriores , su nueva estructura y sus requisitos menos prescriptivos les ayuda a implementar más fácilmente los mismos y facilita la organización sus procesos de gestión, operativos y de soporte. Por otro lado la orientación hacia el cuidado del paciente, la gestión de riesgo, la inclusión de requisitos para POCT y para situaciones de emergencias, aportan un nuevo enfoque para la implementación y acreditación de esta norma contribuyendo a asegurar la competencia del personal y la calidad de los resultados de análisis.
